鋰電池制漿工藝——漿料分散與穩定化機制
根據物質存在的狀態不同,通常可將物質相態分為固態、液態和氣態,此外在固態和液態之間還存在著另一種特殊的物質相態,諾貝爾獎獲得者Pierre-Gilles de Gennes將此類物質稱為"軟物質"。
軟物質主要包括聚合物、液晶、表面活性劑、膠體、乳狀液、泡沫、懸浮液以及生物大分子等,其最大特點是在外界刺激下能作出相當顯著的響應和變化。膠體、懸浮液等軟物質同時也是日常中廣泛研究和應用的分散體系,分散體系是指一種或幾種物質分散在另一種物質中,其中被分散的物質稱為分散相,另一種物質稱為分散介質。根據分散相顆粒的大小不同可將其分為分子分散體系(顆粒半徑<1nm)、膠體分散體系(1nm<顆粒半徑<100nm)和懸浮液(顆粒半徑>100nm)。
鋰電池漿料主要由活性物質、導電劑、粘結劑及溶劑等組成,其分散相由不同粒徑、形貌、密度的顆粒組成,對應的分散介質分為油性溶劑NMP(常作為正極漿料溶劑)和水性溶劑去離子水(常作為負極漿料溶劑)。因此鋰電池漿料同泥沙、涂料、陶瓷漿料一樣,也屬于一種懸浮液。在鋰電池極片制備過程中,制漿工藝作為最前端工序,其獲得的漿料質量及工藝穩定性對整個生產工藝將產生重大影響,因此研究和分析制漿過程中漿料的分散和穩定化機制,是獲得高度分散、成分均勻、性能穩定的漿料的理論保障。
1.粉料團聚
鋰電池制漿過程中涉及的粉體材料主要包括微米級的活性顆粒、納米級的導電劑,粘結劑通常預攪拌后獲得粘結劑膠液。在粉體材料制備、干燥及后處理等不同階段,粒子間容易形成帶有若干連接界面的團聚體。根據顆粒的團聚大小可將其分為原生顆粒、凝聚體、附聚體和絮凝體等形式(圖1所示)。
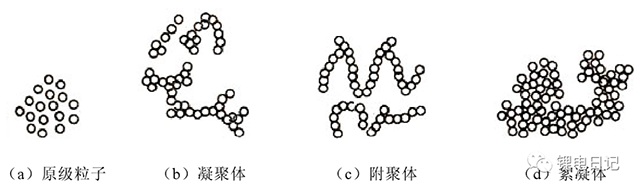
圖1 粉體顆粒的不同聚合狀態
原生顆粒:單個顆粒或晶體的粒子,稱為原生粒子;
凝聚體:原生粒子之間以面相接,不加外界能量無法將其分開;
附聚體:指原生粒子之間以點、角相接形成的團簇或小顆粒在大顆粒上的吸附;
絮凝體:由于體系表面積的增加,為了降低表面能而生成的更加松散的結構。
此外,根據團聚體中顆粒間的相互作用力的不同及團聚方式的差異可將粉體團聚分為硬團聚(hard agglomerates)和軟團聚(soft agglomerates)。硬團聚由顆粒間強的化學鍵作用形成,在粉末的加工成型過程中其結構不易被破壞;軟團聚則是由范德華力、靜電引力、毛細管力等較弱的力引起的微粒團,可通過一些化學作用或施加機械作用方式來消除,如圖2所示為SiO2顆粒團聚體結構和形貌照片。
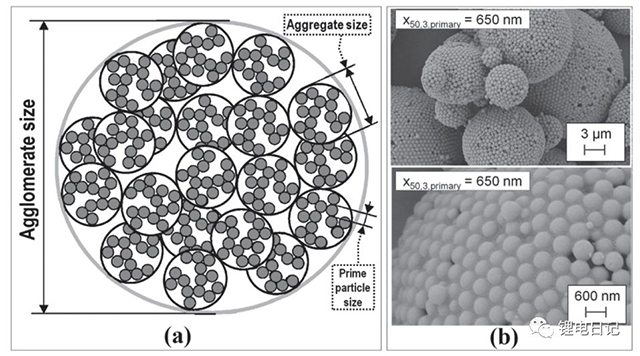
圖2 團聚體顆粒結構示意圖及SiO2團聚體SEM形貌
關于粉體顆粒團聚機制目前已存在不同理論,導致粉料軟團聚的原因包括:
尺寸效應:隨著顆粒尺寸減小至納米級,顆粒比表面積顯著增加,表面原子比和活性基團迅速增多,活性顆粒碰撞團聚;
表面電子效應:納米顆粒表面配位不足,存在大量的晶體缺陷和不飽和鍵,表面電荷的聚集使顆粒表面極不穩定,易于團聚;
表面能效應:納米顆粒表面積大,表面能高,處于能量的不穩定狀態,很容易發生聚集而趨于穩定狀態。
近距離效應:納米顆粒間距較小,相互間的范德華爾斯力遠大于重力,顆粒間易通過分子間引力而團聚。
關于顆粒硬團聚機制,目前沒有統一的理論對此進行解釋,主要包括以下理論:
化學鍵理論:化學鍵理論認為存在于凝膠表面的非架橋羥基是產生硬團聚的根源。
毛細管吸附理論:毛細管吸附理論認為硬團聚主要是納米粉體在分離和干燥過程中,隨著水分子的排除產生的毛細管作用造成的。
氫鍵理論:氫鍵理論認為氫鍵作用是導致納米顆粒產生硬團聚的主要原因。
晶橋理論:晶橋理論建立在納米粉體在分散介質中有一定溶解現象的基礎上,部分原子和表面羥基在介質中發生溶解一沉析形成晶橋而使顆粒變得更加緊密。
表面原子擴散理論:在高溫分解后得到的粉體顆粒表面原子具有很高的活性,表面斷鍵產生的能量遠遠高于粉體內部原子的能量,表面原子很容易擴散到相鄰顆粒表面并與對應的原子發生鍵合,形成穩固的化學鍵從而導致了硬團聚。
2. 制漿宏觀與微觀過程
鋰電池制漿工藝主要目的是將活性物質、導電劑、粘結劑等物質均勻分散,獲得均勻、穩定的漿料用于極片涂布工藝。理想的電極結構如圖3所示,各組分顆粒均勻散、無團聚,活性顆粒和導電劑、粘結劑充分接觸,形成良好的電子導電和離子導電網絡。制漿工藝的宏觀過程為不同組分的分散與均勻混合,微觀過程則涉及制漿過程中顆粒間的相互作用和穩定化網絡結構的形成。鋰電池制漿中顆粒的分散包括以下步驟(圖4所示):
固體顆粒在液相中的浸潤;
固體顆粒團聚體在機械力作用下的解聚和分散;
解聚后的漿料穩定化,防止再次團聚。
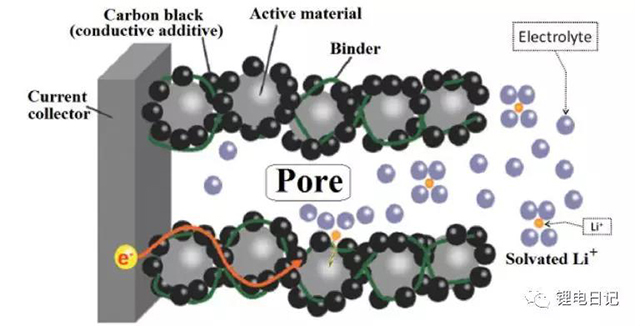
圖3 鋰電池理想電極結構示意圖
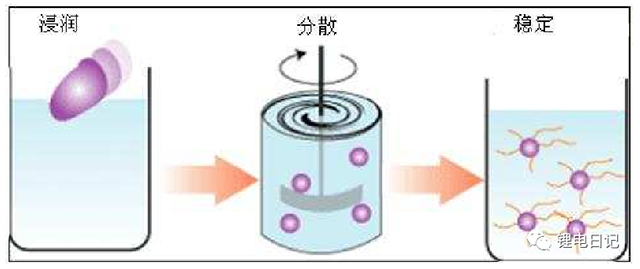
圖4 鋰電池制漿主要過程
2.1 粉體顆粒的潤濕
潤濕是將粉體緩慢地加入液體體系中,使吸附在粉體表面的空氣或其他雜質被液體取代的過程。電極材料表面的潤濕主要是由液相表面與顆粒表面的極性差異程度決定,粉體在液相中潤濕的好壞是粉體能否均勻分散的重要前提,潤濕不好會產生團聚、結塊,會影響到后面進一步的分散混合。粉體顆粒與溶劑的潤濕性能通常采用潤濕角來表征,潤濕角與固——液界面張力大小有關。根據潤濕角的大小可將粉料與溶劑的潤濕性分為四個等級:θ=0,強親水性;0<θ<40°,弱親水性;40<θ<90°,弱疏水性;θ>90°,強疏水性。此外也可采用潤濕熱來表征潤濕性,潤濕熱越大,粉料與溶劑的潤濕性越好。
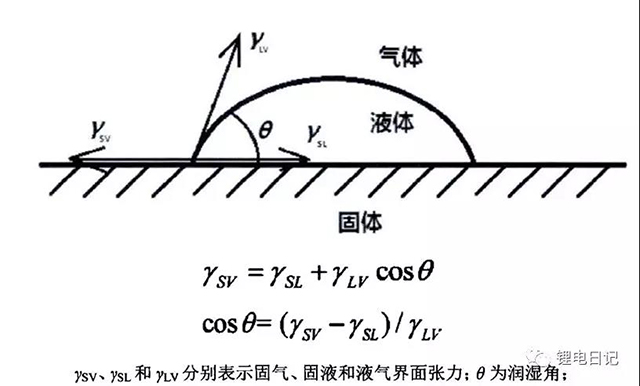
圖5 固體顆粒與溶劑的接觸界面作用力及接觸角
2.2 團聚體解聚
鋰電池制漿過程中顆粒團聚體在剪切力、離心力、壓應力、慣性力等作用下發生解聚分散,初始較大的團聚體破碎、分散形成較小的顆粒。如圖6所示為粉體顆粒機械攪拌過程中受力類型以及不同分散體系解聚過程示意圖。團聚體顆粒的解聚過程可進一步細化為三個階段:侵蝕(erosion)、破裂(rupture)、粉碎(shattering),如圖7所示。侵蝕通常發生在低能攪拌階段,此時細小的顆粒碎片在剪切力作用下從團聚體表面脫落;隨著攪拌強度和時間的增加,初始大的團聚體分解為較小的團簇,此階段為破裂;攪拌強度不斷增加,大的團聚體迅速解聚為細小的顆粒聚合體,此過程稱為粉碎。根據機械攪拌強度的差異,三過程可逐步進行,也可能同時發生。
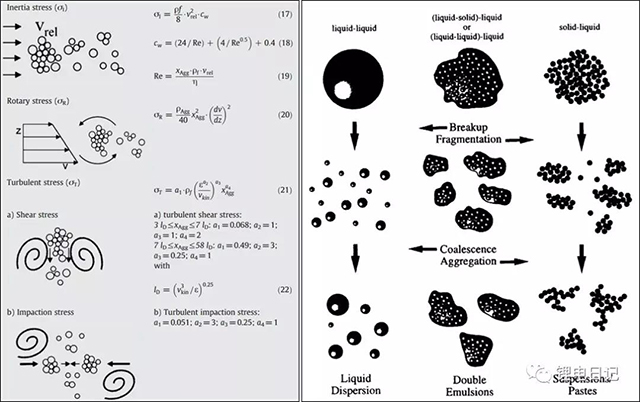
圖6 顆粒機械分散受力類型及解聚過程示意圖
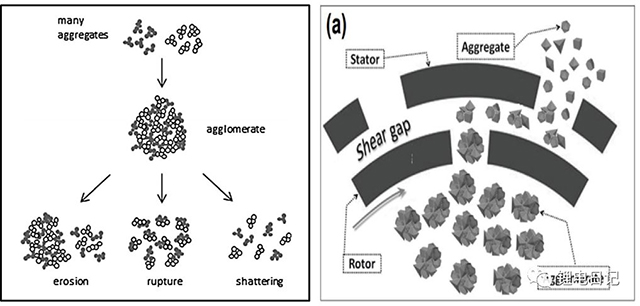
圖7 團聚體顆粒解聚過程示意圖
2.3 漿料穩定化
漿料分散后需防止顆粒物質再次團聚,因此制漿過程中保持漿料的分散穩定性至關重要。漿料分散后是否再次團聚與顆粒間的相互作用力密切相關,目前關于漿料的分散穩定機制已出現不同的理論模型,如圖8所示,主要包括靜電作用穩定機制、空間位阻穩定機制、靜電位阻穩定機制。不同機制的理論依據與顆粒間的相互作用力直接相關,下面分析、總結鋰電池漿料顆粒間的相互作用力。
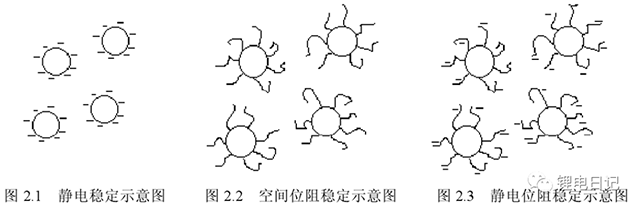
圖8 不同的漿料穩定化模型
3. 漿料中顆粒間的相互作用
鋰電池漿料中各組分顆粒間存在多種相互作用力,包括范德華力、靜電排斥力、空間位阻力、空位力、水合力等,顆粒間相互作用力的大小決定其是否發生團聚。
3.1 范德華力
根據London理論,波動電子分布在原子或分子周圍時產生一種臨時性偶極,.這個臨時性偶極使臨近原子或分子產生偶極,使兩個中性原子或分子之間產生范德華引力,所產生偶極總是使兩個原子之間互相吸引。范德華引力是色散、誘導、取向力的總和,大小與粒子間距離的6次方成反比。真空中距離很近的兩個近似球形粒子之間的的吸引勢能為:
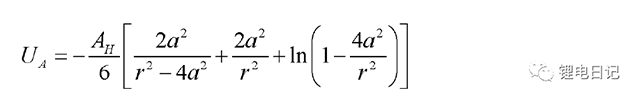
3.2 靜電作用力
如果顆粒間只存在范德華引力,顆粒必定團聚并沉淀析出,使顆粒表面帶電產生靜電排斥力可避免顆粒間的團聚沉淀。實際漿料中顆粒物質會因自身解離、晶格取代或晶格缺失、吸附作用等使顆粒表面帶電。由于顆粒表面電荷的存在,帶電顆粒通過庫侖引力和其他引力將一些反號離子緊密吸附,構成緊密層。在緊密層以外的范圍內,溶液中的正離子和負離子在靜電斥力和熱運動兩種相反作用下呈現出一定的位置分布,這個范圍稱為擴散層。緊密層和擴散層之間的界面稱為斯特恩(Stern)層,這便構成了雙電層,如圖9所示。漿料中顆粒表面相對于溶劑本體處的電位差稱為表面電位?o,斯特恩層與擴散層之間的電位差為斯特恩電位?s,ζ電位為動電位或Zeta電位,Stern層厚度通常以δ表示。
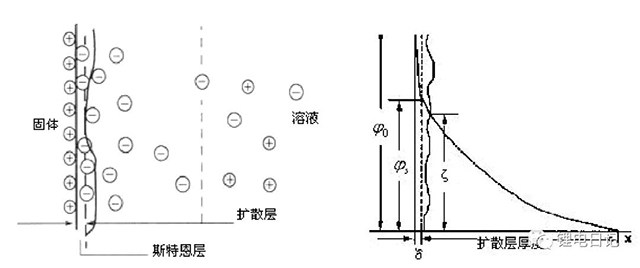
圖9 顆粒表面雙電層及表面電位變化
顆粒物質在溶劑中運動時帶同號的動電位ζ,使得顆粒之間相互排斥,可防止團聚的發生,使顆粒保持分散狀態。顆粒間的靜電排斥作用與其間距有關,如圖10所示,相鄰顆粒的擴散層未發生重疊時沒有斥力的作用,當顆粒相互靠近表面擴散層相互重疊時形成強烈的靜電排斥。
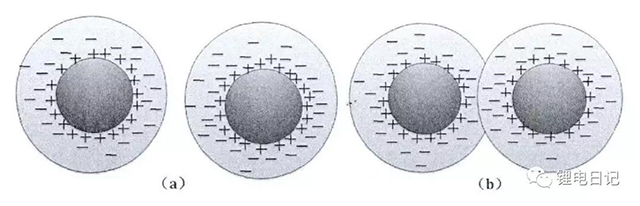
圖10 帶電顆粒表面擴散層重疊現象
對于兩個具有相同尺寸、相同表面電勢的球形粒子,兩顆粒間產生的靜電排斥勢能(如圖11所示為靜電排斥勢能隨顆粒間距的變化)UR大小為:
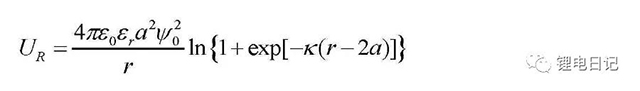
由此可見,漿料中顆粒的Zeta電位最大時,顆粒的雙電層表現為最大斥力,使顆粒分散;當顆粒的 Zeta 電位等于零時(即等電點 IEP),顆粒間的吸引力大于雙電層之間的排斥力,顆粒團聚而沉降。
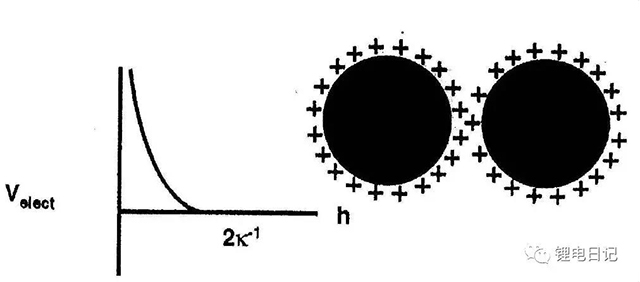
圖11 顆粒間靜電排斥勢能隨顆粒間距的變化
3.3 空間位阻作用力
在漿料中加入一定量的不帶電的高分子化合物,使其吸附在顆粒的周圍,形成較厚的位阻層,使顆粒之間產生空間排斥力。高分子化合物在顆粒表面的吸附可分為三種臥式、環式、尾式三種,如圖12所示。

圖12 高分子化合物在顆粒表面吸附類型
此外吸附高分子聚合物的顆粒物質相互靠近時出現兩種情況,如圖13所示:
(1)吸附層被壓縮而不發生相互滲透;
(2)吸附層發生相互滲透和重疊。
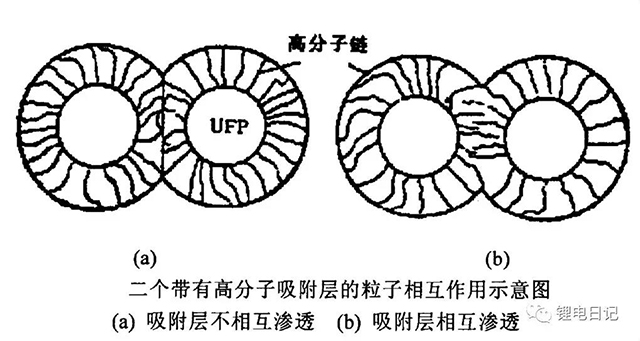
圖13 高分子吸附層相互作用示意圖
兩顆粒間的空間位阻作用勢能大小為:
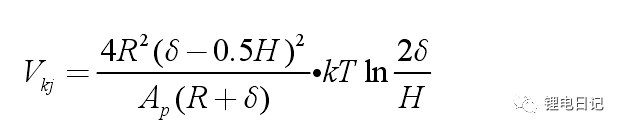
顆粒間的空間位阻作用勢隨顆粒間距的變化如圖14所示:
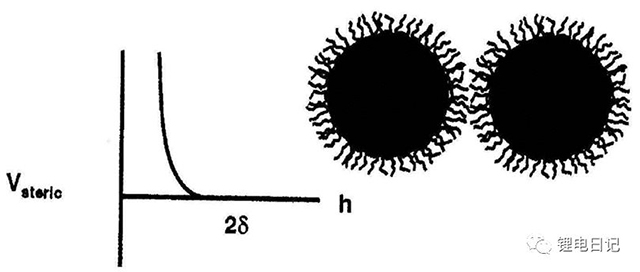
圖14 空間位阻作用勢隨顆粒間距的變化
3.4 溶劑化作用力
當顆粒表面吸附含親水基團的有機物或陽離子時,顆粒表面會形成溶劑化作用,此時若顆粒相互靠近,在其之間就會有很強的排斥作用能產生,稱為溶劑化作用能。對于球形顆粒半徑分別為R1和R2時的溶劑化作用能可以表示為:
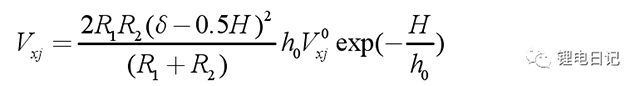
3.5 機械剪切作用力
在鋰電池漿料制備過程中通過機械強力攪拌,漿料中的顆粒物質相互碰撞、擠壓,同時液流剪切使團聚的大顆粒破裂、分散。團聚體分散碎解的直接原因是受到剪應力和壓力的作用,剪應力在分散過程中起到了非常重要的作用,如圖15所示為漿料攪拌分散時所受機械作用示意圖。
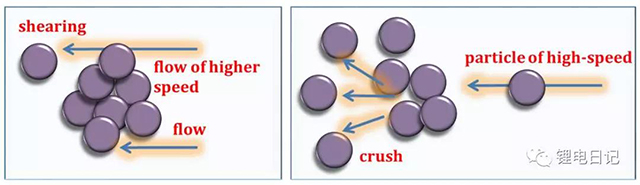
圖15 漿料攪拌分散顆粒受到的機械作用力
4.鋰電池漿料穩定機制
漿料中顆粒間的范德華作用能、靜電排斥作用能、溶劑化作用能及空間位阻作用能的大小關系是決定鋰電池電極漿料分散穩定性的主要因素。漿料分散與團聚的理論判據可用下式表示:
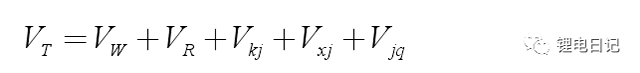
當漿料中顆粒間的相互吸引作用能小于排斥作用能時,則為穩定的分散狀態;反之,漿料將產生團聚。鋰電池漿料屬于懸浮液分散體系,漿料的分散穩定機制可借鑒膠體的穩定機制進行說明。在膠體分散體系中,廣泛應用的穩定機制包括DLVO理論(靜電穩定理論或雙電層穩定機理)、空間位阻穩定機制和靜電位阻穩定機制。
4.1 DLVO理論
DLVO理論是上世紀四十年代由Deriaguin、Landon、Verwey和Overbeek發展起來的研究帶電膠體粒子穩定性的理論,該理論通過膠體粒子的雙電層理論來解釋分散體系的靜電穩定機理,揭示粒子表面所帶電荷與膠體體系穩定性的關系,因此又稱為雙電層排斥理論。DLVO理論認為溶膠在一定條件下是穩定存在還是團聚取決于粒子間的相互吸引力和靜電排斥力兩者的競爭,若斥力大于引力則溶膠穩定,反之則形成團聚。如圖16所示為兩帶電顆粒間的相互作用勢能曲線,當顆粒相距很遠時,顆粒間無相互作用,VT為零;當顆粒開始相互靠近時,范德華引力勢能VvaW迅速增大,而雙電層排斥勢能Vdl增加相對緩慢,此時z總勢能為負值;當顆粒繼續靠近時雙電層排斥勢能曲線急劇上升,總勢能上升為正值。兩顆粒靠近到一定距離時,總勢能達到最大值,稱為“勢壘”,勢壘高度被認為是使顆粒附著而必須克服的活化能。當顆粒能量高到足以克服斥力勢壘,就會導致納米顆粒碰撞在一起發生團聚。雖然DLVO理論忽略了高分子聚合物吸附形成的空間位阻作用力,但該理論成功解釋了稀懸浮液穩定行為,此外根據該理論通過調控漿料pH值和添加電解質等方法,增加表面雙電層厚度和zeta電勢,可增加顆粒間勢壘,從而提高漿料分散穩定性。常用于單純靜電穩定的分散劑一般為小分子量、離子帶電量高的電解質,如:焦磷酸鈉、六偏磷酸鈉、檸檬酸鹽等。
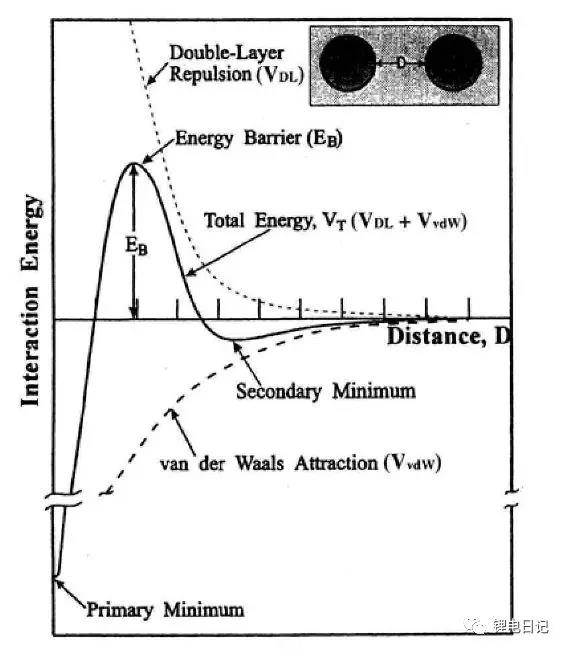
圖16 顆粒間的DLVO相互作用能趨勢圖
4.2 空間位阻穩定機制
在采用DLVO理論解釋顆粒間的穩定機制時忽略了高分子物質產生的空間位阻作用,考慮空間位阻斥力作用對應的總勢能曲線圖如圖17所示。由此可見,空間位阻的存在使顆粒間的總勢能曲線發生了明顯變化,空間位阻勢能提高了顆粒聚集必須克服的能量勢壘,有利于漿料的長期穩定。單純空間位阻穩定的分散劑為分子量高、非離子型聚合物,如:阿拉伯樹膠、明膠、桃膠、羧甲基纖維素、聚乙烯醇、聚乙二醇、鯡魚油等。
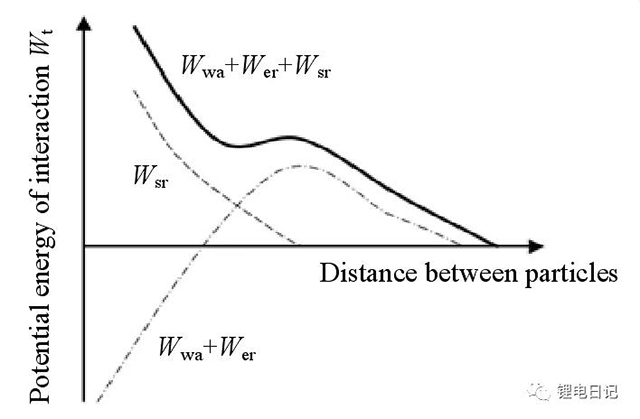
圖17 空間位阻作用下的顆粒間總勢能變化曲線
4.3 靜電位阻穩定機制
在漿料中加入一定量的高分子聚電解質,使粒子的表面吸附聚電解質,此時聚電解質既可通過本身所帶電荷排斥周圍粒子,又能通過其空間位阻效應阻止周圍粒子的靠近,兩者的共同作用可實現復合穩定分散的效果(如圖18所示)。常用靜電位阻分散劑有聚丙烯酸銨、聚丙烯酸鈉、海藻酸鈉、海藻酸銨、木質磺酸鈉、石油磺酸鈉、聚丙烯酸酰銨、水解丙烯酸銨、磷酸脂、乙氧基化合物等。
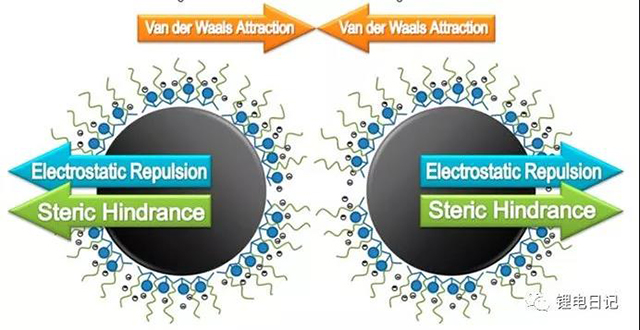
圖18 靜電位阻穩定機制示意圖
5. 總結
鋰電池漿料為多相復合懸浮液,漿料中的顆粒物質間存在多種相互作用,包括范德華引力作用、靜電排斥作用及空間位阻作用等。漿料中顆粒是否分散均勻或發生團聚與顆粒間總勢能大小密切相關,要實現漿料各組分的均勻分散需提高顆粒間勢壘大小,減小顆粒布朗運動越過勢壘而團聚。從提高漿料顆粒斥力作用方向考慮,改善鋰電池漿料分散均勻性策略包括:
提高機械分散強度,增加機械剪切作用力時顆粒團聚體充分解聚分散;
調節和控制漿料pH值或添加無機電解質,增加顆粒表面Zeta電勢,提高靜電排斥力;
添加分散劑或表面活性劑,利用高分子化合物表面吸附提高空間位阻作用強度。
本文鏈接:http://m.qhgfjy.com.cn{dede:field.arcurl/}
諾信新聞,諾信公司新聞,鋰電池行業新聞,展會新聞