鋰離子電池詳解及納米材料在鋰離子電池中的應(yīng)用
鋰離子電池詳解及納米材料在鋰離子電池中的應(yīng)用。浩瀚幾千年人類(lèi)社會(huì)的發(fā)展史是科學(xué)技術(shù)的進(jìn)步史,卻也是資源耗盡、環(huán)境污染的血淚史。進(jìn)入21世紀(jì),人類(lèi)在享受科學(xué)發(fā)展所帶來(lái)的高品質(zhì)生活的同時(shí),卻不得不面對(duì)日趨嚴(yán)重的資源緊缺、環(huán)境污染等問(wèn)題。因此,新型清潔能源的開(kāi)發(fā)和應(yīng)用成為迫在眉睫的首要問(wèn)題,并且已經(jīng)成為世界經(jīng)濟(jì)中具有決定性影響力的一項(xiàng)科學(xué)技術(shù),與之相應(yīng)的儲(chǔ)能技術(shù)特別是化學(xué)電源的使用也亟待進(jìn)一步提高。
在眾多的新型清潔能源中,鋰離子電池(Li-ion Batteries)由于具有體積小、質(zhì)量輕、能量密度大、循環(huán)穩(wěn)定性好、自放電小、無(wú)記憶效應(yīng)、安全可靠、無(wú)污染等突出的優(yōu)點(diǎn),已經(jīng)吸引了研究者廣泛的關(guān)注。并且已經(jīng)成為移動(dòng)電話(huà)、筆記本電腦、平板電腦等個(gè)人便攜式終端的重要化學(xué)電源,未來(lái)將成為混合動(dòng)力汽車(chē)、電動(dòng)汽車(chē)等日常交通工具和人造衛(wèi)星、宇宙飛船、潛艇、魚(yú)雷、導(dǎo)彈、火箭、飛機(jī)等現(xiàn)代高科技產(chǎn)品的重要化學(xué)電源之一。
我國(guó)在鋰離子電池的研制方面取得了很大的進(jìn)展,并開(kāi)始規(guī)模生產(chǎn)。國(guó)家中長(zhǎng)期科學(xué)和技術(shù)發(fā)展規(guī)劃綱要(2006~2020年)已將高效能源材料技術(shù)列為重點(diǎn)發(fā)展的前沿技術(shù)之一,高效二次電池材料及關(guān)鍵技術(shù)是其中重要的組成部分。因此,新型電極材料的制備和研究已經(jīng)成為鋰離子電池研究領(lǐng)域最為活躍的方向之一。
一、鋰離子電池的發(fā)展歷史
鋰元素為堿金屬,相對(duì)原子質(zhì)量為6.941,熔點(diǎn)為181.5℃,密度為0.53g/cm3。由于鋰是一種非常輕的元素,同時(shí)電極電勢(shì)非常低(相對(duì)于標(biāo)準(zhǔn)氫電極為-3.04V),因此鋰離子電池體系理論上具有最大的能量密度。
鋰原電池的研究始于20世紀(jì)50年代,由于石油危機(jī)的爆發(fā)迫使人們?nèi)ふ倚碌奶娲茉础T诒姸嗟慕饘僭刂校饘黉囎钶p、氧化還原電位最低、質(zhì)量能量密度最大,因此長(zhǎng)期以來(lái)受到化學(xué)電源工作者的極大關(guān)注。
1958年,美國(guó)加州大學(xué)的一位研究生最早提出以鋰、鈉等活潑金屬作為負(fù)極的設(shè)想,此后研究者開(kāi)始從事這方面的研究工作。
1962年美國(guó)軍方的Chilton Jr.和Cook提出了“鋰非水電解質(zhì)體系”的設(shè)想。
1970年埃克森的Whittingham M.S.采用硫化鈦?zhàn)鳛檎龢O材料,金屬鋰作為負(fù)極材料,制成首個(gè)鋰電池。
1980年,Goodenough J.提出了氧化鈷鋰作為鋰離子電池正極材料,揭開(kāi)了鋰離子電池的雛形。
1985年發(fā)現(xiàn)碳材料可以作為鋰充電電池的負(fù)極材料,發(fā)明了鋰離子電池。
1986年完成了鋰離子電池的原始設(shè)計(jì),并實(shí)現(xiàn)了Li//MoS2充電電池的商業(yè)化。
但是該電池于1989年發(fā)生起火事故導(dǎo)致了該充電電池的終結(jié)。
直到1991年索尼公司發(fā)布首個(gè)商用鋰離子電池。以碳材料為負(fù)極,以含鋰的化合物作正極,并且提出了“搖椅式電池”的概念。至此,鋰離子電池開(kāi)始了大規(guī)模的商用化應(yīng)用,同時(shí)也革新了電子產(chǎn)品的面貌。
鋰離子電池的組成及工作原理
當(dāng)前商品化的鋰離子電池主要由正極、負(fù)極、電解質(zhì)和隔膜四個(gè)部分組成。正極,放電時(shí)發(fā)生還原反應(yīng),采用較多的是過(guò)渡金屬氧化物,如鈷酸鋰、錳酸鋰、磷酸亞鐵鋰等。負(fù)極,放電時(shí)發(fā)生氧化反應(yīng),應(yīng)用較多的是碳材料,如石墨、焦炭和瀝青中間相碳微球等。鋰離子電池的電解質(zhì)作為純離子導(dǎo)體,通常是溶解了鋰鹽(如LiPF6)的有機(jī)碳酸酯溶液。多孔聚合物則作為隔膜被置于正負(fù)極之間,為正、負(fù)極提供電子隔離,防止正負(fù)極直接接觸而導(dǎo)致電池短路。
鋰離子電池實(shí)際上是一種鋰離子濃差電池,充電時(shí),Li+從正極脫出,經(jīng)過(guò)電解液嵌入到負(fù)極,負(fù)極處于富鋰狀態(tài),同時(shí)電子的補(bǔ)償電荷從外電路供給到碳負(fù)極,以確保電荷的平衡。放電時(shí)則相反,Li+從負(fù)極脫出,經(jīng)過(guò)電解液嵌入到正極材料中,正極處于富鋰狀態(tài)。鋰離子電池工作原理如圖1所示。
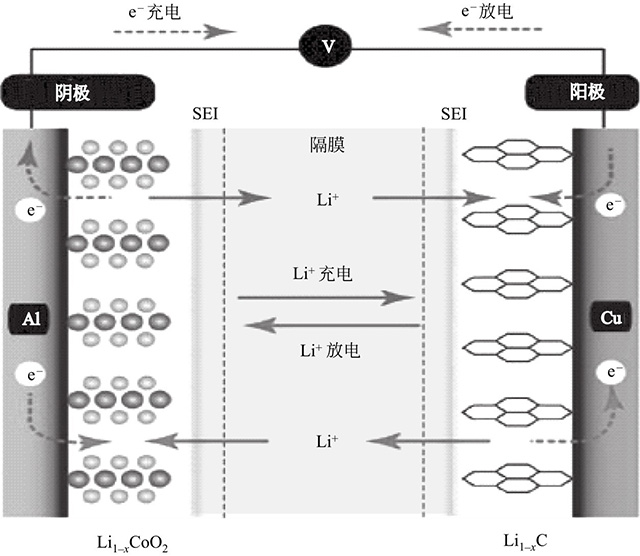
圖1 鋰離子電池工作原理
鋰離子電池的化學(xué)表達(dá)式為:
(+)LiCoO2|電解液|石墨(-)
在充放電過(guò)程中,有如下電化學(xué)反應(yīng):
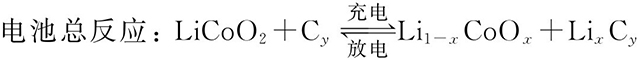
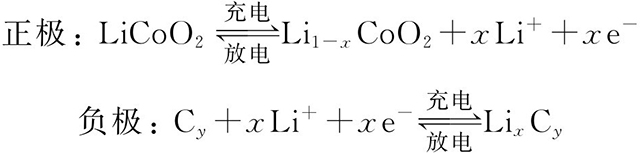
圖1說(shuō)明了典型的鋰離子電池的充放電原理(以石墨為負(fù)極,鈷酸鋰為正極為例)。
在充電過(guò)程中,鈷酸鋰失去電子,鋰離子從鈷酸鋰晶格中逸出,其中的離子Co3+氧化為Co4+,而從正極中脫嵌出的鋰離子,經(jīng)由電場(chǎng)提供動(dòng)力,電解液對(duì)離子的傳輸作用,通過(guò)隔膜嵌入石墨負(fù)極中的層狀結(jié)構(gòu)中,此時(shí)鋰離子得到電子被還原成金屬鋰原子與石墨形成LiC6化合物。
在放電過(guò)程中,LiC6化合物失去電子,鋰離子從石墨層間脫出,經(jīng)過(guò)電場(chǎng)的驅(qū)動(dòng),電解液對(duì)離子的輸運(yùn),通過(guò)隔膜嵌入鈷酸鋰正極中,此時(shí)鈷酸鋰得到電子,鋰離子則嵌入LiCoO2晶格中,其中的離子Co4+還原為Co3+。
在正常充放電情況下,鋰離子在層狀結(jié)構(gòu)的碳材料和過(guò)渡金屬氧化物的層間嵌入和脫出,一般只引起層間距的變化,而不會(huì)引起晶體結(jié)構(gòu)的破壞,伴隨充放電的進(jìn)行,正、負(fù)極材料的化學(xué)結(jié)構(gòu)基本保持不變,故鋰離子電池也常稱(chēng)為搖椅式電池(rocking-chair battery)。
鋰離子電池的結(jié)構(gòu)和特點(diǎn)
鋰離子電池已經(jīng)被廣泛應(yīng)用于各個(gè)領(lǐng)域中,因此,其種類(lèi)、類(lèi)型和構(gòu)造也同樣具有多樣性。根據(jù)所用電解質(zhì)的狀態(tài)可分為液體鋰離子電池和全固態(tài)鋰離子電池。目前商業(yè)化的鋰離子電池可根據(jù)電池的形狀和組成材料進(jìn)行分類(lèi)。電池包括圓柱形、扣式和方形3種形狀,如圖1-2(a)~(c)所示,聚合物鋰離子電池除制成上述形狀外,還可根據(jù)需要制成任意形狀,如圖1-2(d)所示。
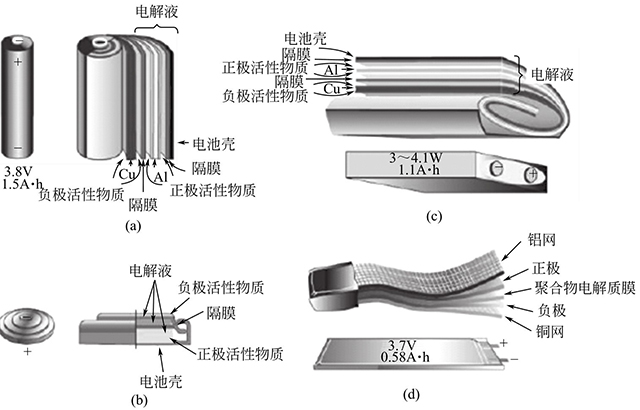
圖1-2 常見(jiàn)的鋰離子電池構(gòu)造
常見(jiàn)的鋰離子電池構(gòu)造
鋰離子電池之所以引起了研究者的廣泛關(guān)注,是因?yàn)槠渚哂泻芏嗒?dú)特的優(yōu)勢(shì),目前鋰離子電池有以下優(yōu)點(diǎn)。
①鋰離子電池的比容量高,工作電壓高。鋰離子電池的單節(jié)電壓為3.6V,因而具有更高的質(zhì)量比能量。鋰離子電池的實(shí)際質(zhì)量比能量已經(jīng)達(dá)到140W·h/kg,體積比能量約為300W·h/L,而常用的Cd-Ni電池的質(zhì)量比能量和體積比能量分別是40W·h/kg和125W·h/L,MH-Ni電池的質(zhì)量比能量和體積比能量分別是60W·h/kg和165W·h/L。
②鋰離子電池具有非常好的荷電保持能力,允許工作溫度范圍寬。當(dāng)環(huán)境溫度為(20±5)℃時(shí),在開(kāi)路狀態(tài)下存儲(chǔ)30天后,電池放電容量為額定容量的85%。鋰離子電池可以在比較寬的溫度區(qū)間運(yùn)行,通常可以在-20~60℃的范圍內(nèi)正常工作,具有優(yōu)良的高低溫放電性能,高溫性能優(yōu)于其他電池。
③鋰離子電池循環(huán)壽命長(zhǎng)、安全性高以及無(wú)記憶效應(yīng)。鋰離子電池的循環(huán)性能遠(yuǎn)遠(yuǎn)高于其他各類(lèi)電池,在優(yōu)良的環(huán)境下,可以?xún)?chǔ)存5年以上。具有長(zhǎng)期使用的經(jīng)濟(jì)性。可隨時(shí)反復(fù)充、放電使用。對(duì)于電動(dòng)汽車(chē)和混合動(dòng)力汽車(chē),這一點(diǎn)是非常重要的。
④鋰離子電池體積小、質(zhì)量輕、比能量高。通常鋰離子電池的比能量可達(dá)鎳鎘電池的2倍以上,與同容量鎳氫電池相比,體積可減小30%,重量可降低50%,因此非常適合于便攜式電子設(shè)備,未來(lái)更是實(shí)現(xiàn)電動(dòng)汽車(chē)商用化的關(guān)鍵。
表1-1 鋰離子電池和鎳鎘、鎳氫、鉛酸電池的比較
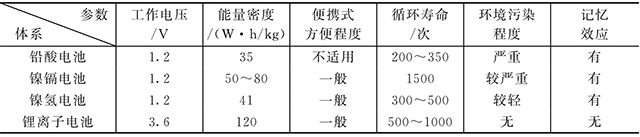
盡管鋰離子電池具有很多的優(yōu)點(diǎn),卻也具有明顯的缺點(diǎn)。
①鋰離子電池內(nèi)部阻抗高。因?yàn)殇囯x子電池的電解液為有機(jī)溶劑,其電導(dǎo)率比鎳鎘電池、鎳氫電池的水溶液電解液要低,所以,內(nèi)部阻抗比鎳鎘、鎳氫電池約大11倍。
②鋰離子電池成本較高。當(dāng)前所用的鋰離子電池成本較高,成為限制電動(dòng)車(chē)商用化的瓶頸。主要是正極材料LiCoO2的價(jià)格較高,隨著正極技術(shù)的不斷發(fā)展,可使用的正極材料的范圍正在被不斷擴(kuò)大,從而可以大大降低鋰離子電池的成本。
③鋰離子電池必須有特殊的保護(hù)電路,以防止其過(guò)充。由于工作電壓高,所以與普通電池的相容性差。
相比鋰離子電池的優(yōu)點(diǎn),這些缺點(diǎn)不是主要問(wèn)題,特別是用于一些高科技產(chǎn)品中,因此應(yīng)用范圍非常廣泛。更何況,科研工作者正在不斷地努力,以尋找價(jià)格更便宜、性能更優(yōu)異的電極材料,從而克服現(xiàn)有的缺點(diǎn),使鋰離子電池在更多領(lǐng)域中得到應(yīng)用。
鋰離子電池常見(jiàn)的正極材料
正極材料是鋰離子電池的一個(gè)重要組成部分,在鋰離子充放電過(guò)程中提供正負(fù)極嵌鋰化合物間往復(fù)嵌脫所需要的鋰。鋰離子電池正極材料一般為嵌入化合物(intercalation compounds),作為理想的正極材料,應(yīng)滿(mǎn)足以下要求:
①金屬鋰離子在嵌入化合物中應(yīng)具有較高的氧化還原電勢(shì),從而保證電池的輸出電壓高而穩(wěn)定;
②應(yīng)有足夠多的位置接納鋰離子,大量的鋰能夠發(fā)生可逆嵌入和脫嵌,以使電極具有較高的比容量;
③在鋰離子嵌入和脫出過(guò)程中,材料結(jié)構(gòu)沒(méi)有或很少發(fā)生變化,以使電池具有良好的循環(huán)性能;
④嵌入化合物應(yīng)有較高的電子電導(dǎo)率和離子電導(dǎo)率,從而減小極化,并且能夠進(jìn)行大電流充放電;
⑤在整個(gè)充放電電壓范圍內(nèi),應(yīng)具有較高的化學(xué)穩(wěn)定性,不與電解質(zhì)發(fā)生反應(yīng);
⑥從實(shí)用角度而言,還應(yīng)該考慮到嵌入化合物的資源豐富、生產(chǎn)成本低和對(duì)環(huán)境無(wú)污染等特點(diǎn)。
目前常用的鋰離子電池正極材料主要有層狀結(jié)構(gòu)的LiMO2(M=Co,Ni,Mn)和Li[Co,Ni,Mn]O2,橄欖石結(jié)構(gòu)的LiMPO4(M=Fe,V,Co,Ni,Mn,Cu),尖晶石結(jié)構(gòu)的LiMn2O4和五氧化二釩(V2O5)等。
在層狀結(jié)構(gòu)材料中,LiCoO2的研究最為成熟并已商業(yè)化。LiCoO2屬于二維層狀結(jié)構(gòu),理論比容量為273mA·h/g,實(shí)際比容量只有130~140mA·h/g,放電電壓為3.9V。LiCoO2作為正極材料具有比容量和放電平臺(tái)高,生產(chǎn)工藝成熟等優(yōu)點(diǎn),因此在便攜式計(jì)算機(jī)和多功能智能手機(jī)等電子產(chǎn)品中有廣泛應(yīng)用。但是鈷酸鋰存在成本高、毒性大、對(duì)環(huán)境污染嚴(yán)重等缺點(diǎn),這些缺點(diǎn)限制了其在動(dòng)力電池領(lǐng)域的應(yīng)用,因此不適合未來(lái)能源存儲(chǔ)發(fā)展的需要。
LiNiO2結(jié)構(gòu)與LiCoO2類(lèi)似,理論比容量為275mA·h/g,實(shí)際比容量為190~210mA·h/g,工作電壓為2.5~4.1V。相對(duì)于LiCoO2,其容量更高,環(huán)境友好并且原料的價(jià)格便宜,但缺點(diǎn)是熱穩(wěn)定性差,容量衰減依然很快,并且合成十分困難。這使得LiNiO2至今沒(méi)有商業(yè)化應(yīng)用。
Li[Co,Ni,Mn]O2的結(jié)構(gòu)與LiCoO2類(lèi)似,其中三種元素對(duì)材料的電化學(xué)性能有各自的影響。Co能提高材料結(jié)構(gòu)的穩(wěn)定性,使層狀結(jié)構(gòu)的陽(yáng)離子有序排列;Ni能提高材料的電化學(xué)活性,使材料比容量更大;Mn能提高材料比容量和安全性,降低成本。三元復(fù)合材料Li[Co,Ni,Mn]O2和一元材料相比,具有成本低、環(huán)境危害小、結(jié)構(gòu)穩(wěn)定、循環(huán)性能好、容量高等優(yōu)點(diǎn),具有商業(yè)化的潛力和廣闊的應(yīng)用前景。
橄欖石結(jié)構(gòu)的LiMPO4(M=Fe,V,Co,Ni,Mn,Cu)磷酸鹽系材料均可作為鋰離子電池的正極,不同的元素有不同的比容量和放電電壓平臺(tái)。目前比較常用的是LiFePO4。其理論比容量為170mA·h/g,實(shí)際可達(dá)160mA·h/g,工作電壓為3.5V,熱穩(wěn)定性和循環(huán)性能較好。LiFePO4脫鋰后轉(zhuǎn)變成結(jié)構(gòu)和體積類(lèi)似的FePO4,這使得其結(jié)構(gòu)很穩(wěn)定并且循環(huán)性能十分優(yōu)異。雖然其電導(dǎo)率和離子遷移率都不高,但可以通過(guò)制備納米尺度的電極材料來(lái)改善。LiFePO4的缺點(diǎn)是包裝過(guò)程中振實(shí)密度低,因此很難生產(chǎn)出高能量密度的LiFePO4電池,從而限制了其在電動(dòng)汽車(chē)和其他大規(guī)模儲(chǔ)能上的應(yīng)用。
相比之下,尖晶石結(jié)構(gòu)的LiMn2O4具有三維隧道結(jié)構(gòu),理論容量為148mA·h/g,實(shí)際容量可達(dá)130mA·h/g以上。LiMn2O4具有優(yōu)良的大電流充放電性能,原料資源豐富,價(jià)格低廉并且無(wú)毒,是一種環(huán)境友好型的材料,而且電壓平臺(tái)比較高。但是其實(shí)際容量比較低(小于120mA·h/g)從而造成低的能量密度,而且其循環(huán)性能不穩(wěn)定,在充放電過(guò)程中出現(xiàn)導(dǎo)致電子自旋狀態(tài)發(fā)生變化的Jahn-teller型畸變效應(yīng)降低了電極材料的可逆電化學(xué)活性,因此限制了其未來(lái)的大規(guī)模應(yīng)用。
與上述正極材料相比,研究者發(fā)現(xiàn)釩氧化物正極材料具有較高的理論嵌鋰容量和比容量,而且具有資源豐富、價(jià)格便宜等優(yōu)點(diǎn)。因此,釩氧化物成為一種最具有發(fā)展前途的鋰離子電池正極材料。在過(guò)渡金屬元素中,釩的價(jià)格比鈷和錳都低,且屬于多價(jià)金屬元素,其化學(xué)性質(zhì)比較活潑,可以與鋰生成多種嵌鋰特性的氧化物,如:V2O5、VO2、V3O8等。但由于V具有三種穩(wěn)定的氧化態(tài)(V5+、V4+、V3+),可形成氧密堆分布,所以釩氧化物作為嵌入鋰離子電池的正極材料具有良好的應(yīng)用前景。
鋰離子電池常見(jiàn)的負(fù)極材料
自從鋰離子電池誕生以來(lái),研究的有關(guān)負(fù)極材料主要包括碳系材料(石墨化碳材料和無(wú)定形碳材料)、合金、氧化物、硅基材料等。作為鋰離子電池負(fù)極材料必須具備以下的基本要求:
①鋰離子對(duì)負(fù)極材料的脫/嵌的氧化還原電位盡量低,接近金屬鋰的電位,從而保證電池的輸出電壓高;
②鋰離子在負(fù)極材料中脫/嵌的可逆程度要盡量的大,首次不可逆容量較小,庫(kù)侖效率較高;
③在整個(gè)脫/嵌過(guò)程中,負(fù)極材料晶胞體積變化小,具有較高的結(jié)構(gòu)穩(wěn)定性、化學(xué)穩(wěn)定性和熱穩(wěn)定性,這樣有助于維持電極的穩(wěn)定,保持循環(huán)容量;
④脫/嵌鋰主體材料的擴(kuò)散系數(shù)比較大,以提高電池的充放電效率和鋰離子嵌入/脫出速度,利于進(jìn)行快速充放電;
⑤負(fù)極材料的電子電導(dǎo)率和離子電導(dǎo)率應(yīng)盡可能的大,這樣可以減少極化,有利于充放電的進(jìn)行;
⑥主體材料具有良好的表面結(jié)構(gòu),能夠與液體電解質(zhì)形成良好的SEI(solid-electrolyte interface)膜;
⑦插入化合物在整個(gè)電壓范圍內(nèi)具有良好的化學(xué)穩(wěn)定性,在形成SEI膜后不與電解質(zhì)等發(fā)生反應(yīng);
⑧從實(shí)用角度而言,負(fù)極材料應(yīng)盡量選用資源豐富、價(jià)格便宜、來(lái)源廣泛,并且制備工藝簡(jiǎn)單的材料,以降低電池成本等,而且負(fù)極材料應(yīng)在空氣中穩(wěn)定、無(wú)毒、對(duì)環(huán)境友好。
目前,鋰離子電池商業(yè)化負(fù)極材料主要是碳素類(lèi)材料,包括石墨、硬碳和軟碳等。碳材料具有電極電位低(<1.0V vs. Li/Li+)、循環(huán)效率高(>95%)、循環(huán)壽命長(zhǎng)、安全性能好、來(lái)源豐富、廉價(jià)易得、無(wú)毒無(wú)害等優(yōu)勢(shì)。
碳材料用于鋰離子電池負(fù)極的研究始于20世紀(jì)80年代,最初為解決安全問(wèn)題而使用嵌脫基質(zhì)負(fù)極LixC6取代金屬鋰。
第一種商品化的鋰離子電池負(fù)極材料為石油焦炭。焦炭類(lèi)材料具有較高的比容量(180mA·h/g),并且和電解液相容性好,能在碳酸丙烯酯的電解質(zhì)中穩(wěn)定存在。但其大的比表面積增加了SEI膜的面積,首次不可逆容量較大。而且焦炭材料具有的無(wú)序性被認(rèn)為有礙提高比容量,因此石墨電極漸漸獲得關(guān)注[20~22]。球形石墨電極,特別是中間相微球(MCMB)具有更高的比容量(350mA·h/g)和低的比表面積。但碳材料的理論容量較低(比容量為200~400mA·h/g)且目前已經(jīng)達(dá)到了理論容量的極限,已經(jīng)無(wú)法滿(mǎn)足日益發(fā)展的電動(dòng)汽車(chē)對(duì)鋰離子電池高容量的要求,因此,研究者開(kāi)始對(duì)新材料進(jìn)行研究。而處于研究中的負(fù)極材料有:a.合金類(lèi)材料;b.金屬氧化物系列;c.其他負(fù)極材料。
在眾多的鋰離子電池負(fù)極材料中,過(guò)渡金屬氧化物比容量普遍高于傳統(tǒng)碳材料,有利于發(fā)展新一代大容量鋰離子電池。同時(shí),金屬氧化物的放電平臺(tái)普遍高于石墨,可以在一定程度上避免鋰枝晶的產(chǎn)生,有利于改善電池安全性能。過(guò)渡金屬氧化物MxOy(M=Mn,F(xiàn)e,Co,Ni,Cu)應(yīng)用于鋰離子電池開(kāi)始于2000年J.M.Tarascon等的開(kāi)創(chuàng)性工作。與傳統(tǒng)的嵌入反應(yīng)(碳材料)及合金反應(yīng)(Si和Sn)機(jī)理不同,過(guò)渡金屬氧化物通過(guò)與鋰發(fā)生可逆的“轉(zhuǎn)換反應(yīng)”來(lái)儲(chǔ)鋰。一般來(lái)說(shuō),Li2O很穩(wěn)定,通常情況下不會(huì)和金屬M(fèi)反應(yīng),但生成的過(guò)渡金屬顆粒M尺寸只有幾個(gè)納米,因此具有高度電化學(xué)活性,能使得Li2O分解。過(guò)渡金屬氧化物通常有較大的首次不可逆容量損失,首次庫(kù)侖效率一般在40%~70%之間。這是因?yàn)殡娊庖簳?huì)在過(guò)渡金屬的表面發(fā)生副分解反應(yīng),形成SEI膜,需要消耗鋰離子,而在隨后的充電反應(yīng)過(guò)程中SEI膜不會(huì)完全分解。然而,過(guò)渡金屬氧化物在循環(huán)穩(wěn)定性方面還不及碳材料,而且首次庫(kù)侖效率都比較低。因此,如何解決過(guò)渡金屬氧化物負(fù)極材料的循環(huán)穩(wěn)定性和提高電極材料的首次庫(kù)侖效率,是鋰離子電池一個(gè)至關(guān)重要的課題。
雖然我們已經(jīng)介紹了作為鋰離子電池電極材料必須具備的基本要求,但是現(xiàn)有的電極材料很難同時(shí)滿(mǎn)足上述要求。因此,研究和開(kāi)發(fā)電化學(xué)性能更優(yōu)異的新型電極材料已成為鋰離子電池研究領(lǐng)域的熱門(mén)課題。
鋰離子電池電解液
電解液包括電解質(zhì)和溶劑兩個(gè)部分,鋰離子電池用電解質(zhì)一般使用六氟磷酸鋰(LiPF6)、高氯酸鋰(LiClO4)、四氟硼酸鋰(LiBF4)、六氟砷酸鋰(LiAsF6)和三氟甲基磺酸鋰(LiCF3SO3)。因?yàn)楦呗人徜嚲哂袕?qiáng)氧化性可能引起安全問(wèn)題而限制了其實(shí)際應(yīng)用,砷具有很強(qiáng)的毒性并且很貴因此不適合實(shí)際應(yīng)用。四氟硼酸鋰和三氟甲基磺酸鋰的離子電導(dǎo)率很低,且三氟甲基磺酸鋰對(duì)鋁箔腐蝕性強(qiáng)而影響了使用。六氟磷酸鋰是當(dāng)前使用較多的電解質(zhì),然而其成本高、熱穩(wěn)定性差、遇水分解等缺點(diǎn)并不能滿(mǎn)足未來(lái)鋰電發(fā)展的需要。
因?yàn)樘妓嶂?lèi)溶劑在較寬的窗口下具有非常好的電化學(xué)穩(wěn)定性,因此得到了廣泛的應(yīng)用。包括碳酸丙烯酯(PC)、碳酸乙烯酯(EC)、碳酸二甲酯(DMC)和碳酸二乙酯(DEC)等。醚類(lèi)有機(jī)溶劑也在鋰離子電池中得到廣泛的應(yīng)用。包括四氫呋喃(THF)、1,3-二氧環(huán)戊烷(DOL)和2-甲基四氫呋喃(2-MeTHF)等。羧酸脂類(lèi)也是一種有效的溶劑。包括γ-丁內(nèi)酯(γ-BL)、丙酸甲酯(MP)、乙酸乙酯(EA)等。這些溶劑之間可以很容易形成混合溶劑而提高鋰離子電池的電化學(xué)性能。
電解液的熱穩(wěn)定性對(duì)鋰離子電池的性能有著很大的影響,因?yàn)殡姵氐膶?shí)際使用環(huán)境溫度變化很大(-40~80℃),電池內(nèi)部受焦耳熱效應(yīng)的影響,有些時(shí)候可以超過(guò)200℃,且有機(jī)溶劑也是非常易于燃燒的,因此很容易造成起火。另一個(gè)問(wèn)題是此類(lèi)電解液電壓窗口低,目前使用的電解液電壓窗口普遍低于4.5V。離子液體是一種在室溫下或者更低溫度下處于液體狀態(tài)的鹽,離子液體比其他的溶劑具有很多優(yōu)點(diǎn):不可燃、不揮發(fā)、溶解能力強(qiáng)、離子電導(dǎo)率高、電化學(xué)和熱穩(wěn)定性好且電壓窗口很寬,是一種理想的鋰離子電池電解液。當(dāng)前離子液體的主要問(wèn)題是黏度高,從而抑制了電池的大電流放電性能。
凝膠聚合物電解質(zhì)是一種固態(tài)電解質(zhì),可以防止鋰離子電池電解液泄漏,改善電池的安全性能,提高全電池比容量,且具有非常高的離子電導(dǎo)率,具有非常好的應(yīng)用前景。當(dāng)前的研究方向是提高電壓窗口和進(jìn)一步改進(jìn)鋰離子電導(dǎo)率。固態(tài)陶瓷電解質(zhì)具有非常好的機(jī)械強(qiáng)度、高的鋰離子傳輸性能以及不可燃等性能而成為當(dāng)前的研究熱點(diǎn)。使用這類(lèi)電解質(zhì)能夠有效改善影響鋰離子電池的安全性能。因?yàn)槠錂C(jī)械強(qiáng)度很強(qiáng),因此可以有效避免鋰枝晶所引起的短路問(wèn)題,同時(shí)其是不可燃燒的,因此使用陶瓷固態(tài)電解質(zhì)的電池很難燃燒。當(dāng)前的主要問(wèn)題是鋰離子電導(dǎo)性還有待改善。
鋰離子電池的應(yīng)用
圖1-3是1996~2005年鋰離子電池產(chǎn)量柱狀圖。如圖1-3所示,鋰離子電池的產(chǎn)量逐年增長(zhǎng)。到2005年,鋰離子電池產(chǎn)量已經(jīng)達(dá)到23.5億塊,發(fā)展相當(dāng)迅速。20世紀(jì)90年代鋰離子電池主要應(yīng)用于各種便攜電子產(chǎn)品。隨著電池技術(shù)的不斷發(fā)展,鋰離子電池的能量密度不斷提高,應(yīng)用范圍也隨之不斷擴(kuò)展,已經(jīng)從信息產(chǎn)品擴(kuò)展到能源交通等領(lǐng)域。鋰離子電池技術(shù)已經(jīng)不是單一的產(chǎn)業(yè)技術(shù),已經(jīng)成為新能源發(fā)展的基礎(chǔ)之一。據(jù)統(tǒng)計(jì)目前我國(guó)電池產(chǎn)量已經(jīng)超過(guò)100億只,已經(jīng)成為電池行業(yè)最大的生產(chǎn)和消費(fèi)國(guó)。該行業(yè)年均產(chǎn)值超過(guò)40億美元,并且鋰電市場(chǎng)未來(lái)幾年仍將保持快速增長(zhǎng),市場(chǎng)潛力巨大。一旦動(dòng)力電池技術(shù)獲得突破,電動(dòng)汽車(chē)很有可能取代燃油車(chē)成為主流。屆時(shí)鋰離子電池的需求量將會(huì)劇增,帶來(lái)巨大的市場(chǎng)價(jià)值。
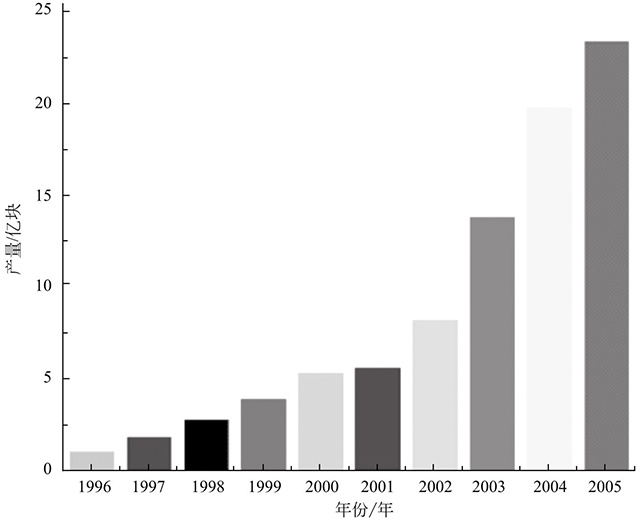
圖1-3 1996~2005年鋰離子電池產(chǎn)量柱狀圖
低成本、高性能、高安全及綠色環(huán)保是未來(lái)鋰離子電池的發(fā)展方向。鋰離子電池作為新能源的代表,優(yōu)勢(shì)明顯,但也有缺點(diǎn)需要改進(jìn)。雖然近年來(lái)在電極材料及電解液方面研究取得許多進(jìn)展,但是距離下一代鋰離子電池的目標(biāo)還有一定差距。隨著中國(guó)越來(lái)越多汽車(chē)的使用,環(huán)境問(wèn)題變得很尖銳,為了解決汽車(chē)引起的環(huán)境污染,使用電動(dòng)汽車(chē)是未來(lái)社會(huì)發(fā)展的必然結(jié)果。
然而盡管當(dāng)前市場(chǎng)上有著小批量電動(dòng)汽車(chē)的使用,但是由于成本太高,普通人并不能夠購(gòu)買(mǎi)如此高昂的汽車(chē)從而限制了電動(dòng)車(chē)的推廣,同時(shí)鋰離子電池的安全性也不佳,出現(xiàn)了多次起火事故。限制電動(dòng)車(chē)發(fā)展的最根本的原因是當(dāng)前使用的電動(dòng)車(chē)的行駛里程太小,充電一次小于120km。為了能夠讓電動(dòng)汽車(chē)商用化,尋找高性能的正極和負(fù)極材料來(lái)提高電動(dòng)車(chē)的行駛里程并且通過(guò)電池系統(tǒng)的設(shè)計(jì)讓電池變得更安全,同時(shí)降低電池的成本,最好能出現(xiàn)3萬(wàn)元左右的小型汽車(chē)并且能夠保證超過(guò)200km的行駛里程,如此便能讓電動(dòng)車(chē)在中國(guó)得到快速的發(fā)展。
鋰離子電池的研究是一項(xiàng)涉及物理、化學(xué)、材料、電子、能源等眾多學(xué)科的交叉領(lǐng)域。隨著研究的不斷深入,鋰離子電池的整體設(shè)計(jì)會(huì)更加合理,并最終實(shí)現(xiàn)在各個(gè)領(lǐng)域的廣泛應(yīng)用。鋰離子電池已經(jīng)創(chuàng)造了輝煌,而未來(lái)必將有更大的輝煌。
二、鋰離子電池納米材料
納米材料簡(jiǎn)介
1959年,著名物理學(xué)家、諾貝爾獎(jiǎng)獲得者理查德·費(fèi)曼曾在一場(chǎng)題為《底層還有許多空間》(There is Plenty of Room at the Bottom)的演講中預(yù)言:將來(lái)人類(lèi)可以用微型化的儀器來(lái)操縱和測(cè)定具有納米結(jié)構(gòu)的材料的性質(zhì),最后將變成根據(jù)人類(lèi)意愿,逐個(gè)地排列原子、制造產(chǎn)品,這是人類(lèi)關(guān)于納米技術(shù)最早的夢(mèng)想。時(shí)至今日,納米技術(shù)已涉及物理、化學(xué)、材料、生物和醫(yī)學(xué)等眾多領(lǐng)域,面對(duì)五花八門(mén)的“納米產(chǎn)品”,納米材料正悄無(wú)聲息地改變?nèi)祟?lèi)的生活,引導(dǎo)人類(lèi)進(jìn)入一個(gè)嶄新的“納米時(shí)代”。正如中國(guó)著名科學(xué)家錢(qián)學(xué)森曾預(yù)言:“納米將會(huì)帶來(lái)一次技術(shù)革命,從而將引起21世紀(jì)又一次產(chǎn)業(yè)革命”。
狹義上的納米材料是指由粒徑小于100nm的納米顆粒所構(gòu)成的超微固體材料;廣義上的納米材料指的是在三維空間中至少有一維的尺寸小于100nm的材料或者由其作為基本結(jié)構(gòu)單元構(gòu)成的材料。
納米材料可分為零維納米材料、一維納米材料和二維納米材料。零維納米材料是指材料在空間的三個(gè)維度上均在100nm以下,即納米微粒、原子團(tuán)簇等。一維納米材料是指材料在兩個(gè)維度上均在100nm以下,即納米絲、納米棒、納米線(xiàn)、納米帶和納米管等。二維納米材料是指材料有一個(gè)維度處于納米尺寸,如超薄膜、石墨烯等。
納米材料的特性
納米材料的特性與其至少有一個(gè)維度的尺寸小于100nm的性質(zhì)密切相關(guān),形象一點(diǎn)來(lái)說(shuō),1nm的長(zhǎng)度相當(dāng)于人類(lèi)發(fā)絲直徑的萬(wàn)分之一。這個(gè)尺度位于以原子和分子為代表的微觀(guān)世界和以人類(lèi)活動(dòng)為代表的宏觀(guān)體系的交界地帶,是聯(lián)系這兩個(gè)重要部分的中間環(huán)節(jié)。因此,納米材料展現(xiàn)出了許多獨(dú)特的性質(zhì)和新的規(guī)律,如量子尺寸效應(yīng)、小尺寸效應(yīng)、表面效應(yīng)、宏觀(guān)量子隧道效應(yīng)及介電效應(yīng)等。
(1)量子尺寸效應(yīng)
隨著粒子尺寸的減小,光生電子及空穴受到空間限域效應(yīng),這些載流子占有軌道的能量比體相材料的更高。當(dāng)粒子尺寸下降到某一值時(shí),金屬費(fèi)米能級(jí)面附近的電子能量由準(zhǔn)連續(xù)變?yōu)殡x散,出現(xiàn)半導(dǎo)體連續(xù)能帶(價(jià)帶和導(dǎo)帶)變?yōu)榉至⒌哪芗?jí)結(jié)構(gòu)及帶隙變寬現(xiàn)象,就是所謂的量子尺寸效應(yīng)。能級(jí)間距大于熱能、光子能量、磁能、靜電能或超導(dǎo)態(tài)的凝聚能時(shí),將會(huì)導(dǎo)致納米微粒的磁、光、聲、熱、電以及超導(dǎo)電性與塊體材料有顯著的不同。
(2)小尺寸效應(yīng)
當(dāng)微粒尺寸與光波的波長(zhǎng)、德布羅意波長(zhǎng)以及超導(dǎo)態(tài)相干長(zhǎng)度或透射深度等物理特性尺寸相當(dāng)或更小時(shí),晶體周期性邊界條件將被破壞;非晶態(tài)納米微粒的顆粒表面層附近原子密度減小,從而導(dǎo)致聲、光、電、磁、熱、力學(xué)特性呈現(xiàn)新的小尺寸效應(yīng)。納米顆粒尺寸小,比表面積大,在熔點(diǎn)、磁學(xué)性能、電學(xué)性能和光學(xué)性能等方面都發(fā)生了較大的變化。
(3)表面效應(yīng)
當(dāng)微粒的尺寸降低到納米尺度時(shí),其表面粒子數(shù)、表面積和表面能均會(huì)大幅度地增加,由于納米粒子表面原子數(shù)增多,原子配位不足及高的表面能,導(dǎo)致納米微粒具有大量的表面缺陷。這些缺陷會(huì)在能量禁阻的帶隙中引入很多表面態(tài),成為電子或空穴的陷阱,嚴(yán)重影響微粒的光學(xué)、光化學(xué)、電化學(xué)及非線(xiàn)性光學(xué)性質(zhì)。由于大的比表面積及大量表面缺陷,這些原子與其他原子相結(jié)合而穩(wěn)定下來(lái),故具有很高的化學(xué)活性。
(4)宏觀(guān)量子隧道效應(yīng)
隧道效應(yīng)是指微觀(guān)粒子具有貫穿勢(shì)壘的能力。近年來(lái),人們發(fā)現(xiàn)一些宏觀(guān)物理量,如微顆粒的磁化強(qiáng)度、量子相干器件中的磁通量等都顯示出隧道效應(yīng),稱(chēng)之為宏觀(guān)量子隧道效應(yīng)。
(5)庫(kù)侖堵塞效應(yīng)及量子隧穿
當(dāng)體系尺度進(jìn)入到納米,體系是電荷“量子化”的,即充電和放電是不連續(xù)的,充入一個(gè)電子所需要能量為e2/2C(C為體系電容),這就導(dǎo)致了小體系充放電過(guò)程中,電子是不能集體傳輸?shù)模且粋€(gè)一個(gè)單電子的傳輸,這種行為被稱(chēng)為庫(kù)侖堵塞效應(yīng)。只有當(dāng)在一個(gè)量子點(diǎn)所加電壓V>e/C時(shí),一個(gè)量子點(diǎn)上的單個(gè)電子才能穿過(guò)能壘到另一個(gè)量子點(diǎn)上,這種行為被稱(chēng)為量子隧穿。由于庫(kù)侖堵塞效應(yīng)的存在,在I-V曲線(xiàn)上,電流隨電壓的上升呈現(xiàn)鋸齒狀臺(tái)階,納米微粒的這一特殊電性質(zhì)成為微電子學(xué)的基礎(chǔ)。
(6)力學(xué)性能效應(yīng)
由于納米粒子細(xì)化,晶界或相界數(shù)量大幅度地增加,可使材料的強(qiáng)度、韌性和超塑性大為提高。其結(jié)構(gòu)顆粒對(duì)光、機(jī)械應(yīng)力和電的反應(yīng)完全不同于微米或毫米級(jí)的結(jié)構(gòu)顆粒,使得納米材料在宏觀(guān)上顯示出許多奇妙的特性。在高分子材料中加入納米顆粒,其強(qiáng)度和韌性都有很大的提高。納米顆粒(如SiO2、CaCO3等)尺寸小,表面積大,填料與基體接觸面積大,而且納米顆粒表面活性中心多,可以與基體緊密結(jié)合,相容性比較好。納米級(jí)顆粒在基體中所起的作用只是最大限度地挖掘基體本身的潛能,當(dāng)復(fù)合物受外力作用時(shí),顆粒不易與基體脫離,而且因?yàn)閼?yīng)力場(chǎng)的相互作用,在基體內(nèi)產(chǎn)生很多的微變形區(qū),吸收大量能量,這就決定了其既能較好地傳遞所受的外應(yīng)力,又能引發(fā)基體屈服,消耗較大沖擊能,達(dá)到同時(shí)增強(qiáng)、增韌的作用。
納米材料在鋰離子電池中的應(yīng)用
在1991年,日本教授、諾貝爾獎(jiǎng)獲得者Iijima在用真空弧蒸發(fā)石墨電極的產(chǎn)物中發(fā)現(xiàn)了納米級(jí)別的碳的多層管狀物——納米碳管。納米碳管的發(fā)現(xiàn)引起大量鋰電池領(lǐng)域科研工作者的廣泛關(guān)注,研究表明,碳納米管作為負(fù)極材料用于鋰離子電池中,其充放電容量可以超過(guò)石墨嵌鋰化合物理論容量的一倍以上。同樣納米化的金屬氧化物也呈現(xiàn)出比現(xiàn)有碳材料(372mA·h/g)更高的理論容量。因此,納米化的金屬氧化物電極材料在鋰離子電池中的應(yīng)用成為了研究的熱點(diǎn)。研究者開(kāi)始制備特殊形貌的金屬氧化物納米材料。這些特殊形貌的納米材料不僅具有較大的比表面積,增加了活性材料與電解液的接觸,提高了鋰離子的擴(kuò)散速率,改善了材料在高倍率充放電的電化學(xué)性能,而且可以有效地減緩電極材料在循環(huán)過(guò)程中的膨脹和粉碎等問(wèn)題,控制容量衰減,提高循環(huán)穩(wěn)定性。在眾多的特殊形貌的納米材料中,空心結(jié)構(gòu)具有明顯的優(yōu)勢(shì),他們可以有效地緩解金屬氧化物在鋰離子脫嵌過(guò)程中產(chǎn)生的體積效應(yīng)。
新加坡國(guó)立大學(xué)樓雄文教授課題組開(kāi)展了大量構(gòu)筑金屬氧化物空心納米結(jié)構(gòu)的工作,并且取得了豐碩的成果。例如,他們利用Cu2O納米立方塊作為模板,通過(guò)加入SnCl4刻蝕模板制備SnO2納米空心立方塊(圖1-4)。將其作為鋰離子電池負(fù)極材料,SnO2納米空心立方塊在156mA/g的電流密度下,即使在低的電壓范圍內(nèi)(0.01~2.0V)循環(huán)40次,仍具有570mA·h/g的容量。高的比容量歸因于空心結(jié)構(gòu)的納米材料有效地縮短了鋰離子的傳輸距離,緩解了充放電過(guò)程中產(chǎn)生的應(yīng)力,從而提高了其結(jié)構(gòu)的穩(wěn)定性。除此之外,他們還利用準(zhǔn)乳液模板的方法制備了Fe2O3納米空心球。相比于實(shí)心Fe2O3納米球展現(xiàn)了增強(qiáng)的性能,在200mA/g的電流密度下,F(xiàn)e2O3納米空心球循環(huán)100次后,比容量仍保持710mA·h/g。明顯地,空心納米結(jié)構(gòu)表現(xiàn)出更優(yōu)異的性能。
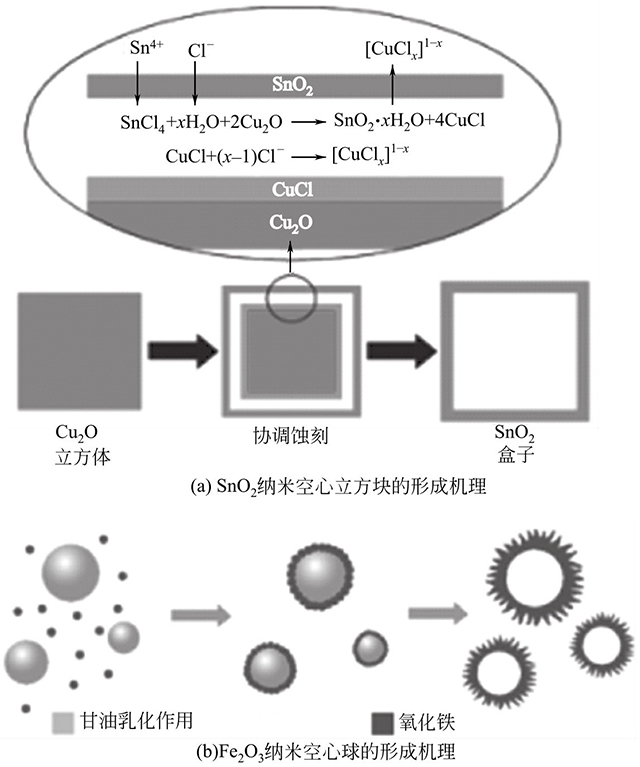
圖1-4 SnO2納米空心立方塊和Fe2O3納米空心球的形成機(jī)理
同樣,他們利用銅納米線(xiàn)作為模板,通過(guò)加入FeCl3后刻蝕模板制備Fe2O3納米管。圖1-5所示,該納米管直徑大約為60nm,表面可以觀(guān)察到許多細(xì)小的納米粒子,是典型的納米粒子組成的納米管狀結(jié)構(gòu)。電化學(xué)性能測(cè)試表明,該電極材料在500mA/g的電流密度下,循環(huán)50圈后容量還能保持初始容量的100%,體現(xiàn)出特別優(yōu)異的循環(huán)穩(wěn)定性。該精心設(shè)計(jì)的多孔納米管有利于鋰離子及電子的傳輸,并能有效地抑制脫嵌鋰造成的體積效應(yīng),因而取得了較為理想的電化學(xué)性能。
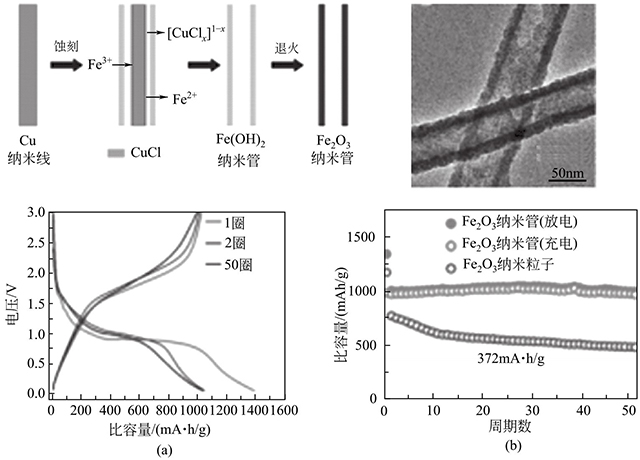
圖1-5 Fe2O3納米管的形成機(jī)理、形貌和電化學(xué)性能
Limin Qi等則以一維的SiO2介孔材料為模板,合成SnO2納米管。如圖1-6所示,該納米管直徑為150~250nm,管壁厚15~20nm。電化學(xué)性能測(cè)試表明,該電極材料在100mA/g的電流密度下,在0.05~1.5V的電壓范圍內(nèi),展現(xiàn)出遠(yuǎn)遠(yuǎn)高于SnO2納米粒子的初始容量(1849mA·h/g和1724mA·h/g)。該精心設(shè)計(jì)的多孔納米管具有較高的比表面積,有利于鋰離子及電子的傳輸,并能有效地抑制脫嵌鋰造成的體積效應(yīng),因而取得了較為理想的電化學(xué)性能。
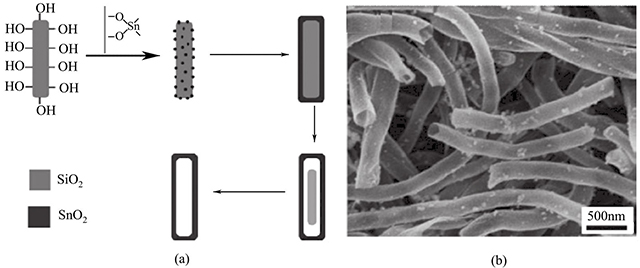
圖1-6 SnO2納米管的形成機(jī)理和形貌
除了空心結(jié)構(gòu)具有優(yōu)異的電化學(xué)性能之外,通過(guò)兩種氧化物復(fù)合形成特殊結(jié)構(gòu)也可以克服金屬氧化物的缺點(diǎn)。復(fù)合后的電極材料不僅因?yàn)榫哂刑厥饨Y(jié)構(gòu),可以有效地抑制脫嵌鋰造成的體積效應(yīng),而且因?yàn)槎叩膮f(xié)同效應(yīng),可以完美地呈現(xiàn)復(fù)合組分各自?xún)?yōu)異的電化學(xué)性能。
Hong Jin Fan等聯(lián)合化學(xué)氣相沉積和水熱過(guò)程制備了Fe2O3/SnO2異質(zhì)納米結(jié)構(gòu),并能夠可控地調(diào)節(jié)復(fù)合材料的組成。如圖1-7所示,該復(fù)合材料具有六次對(duì)稱(chēng)性的樹(shù)枝異質(zhì)納米結(jié)構(gòu)。電化學(xué)性能測(cè)試表明,相對(duì)于兩種單一氧化物,該復(fù)合材料表現(xiàn)出較低的首次不可逆容量和增強(qiáng)的循環(huán)壽命,其性能的提升源于兩種氧化物之間的協(xié)同作用以及枝狀結(jié)構(gòu)較大的比表面積。

圖1-7 Fe2O3/SnO2異質(zhì)納米結(jié)構(gòu)的形成機(jī)理和形貌
Pooi See Lee等聯(lián)合化學(xué)氣相沉積和高溫?zé)峤獾姆椒ㄖ苽淞薞2O5/SnO2核殼納米線(xiàn)。如圖1-8所示,該復(fù)合材料具有直徑約為100nm的核殼結(jié)構(gòu)。電化學(xué)性能測(cè)試表明,該復(fù)合材料表現(xiàn)出高的功率密度(60kW/kg)和高的能量密度(282W·h/kg)。如此優(yōu)異的性能歸因于核殼納米線(xiàn)。薄的V2O5外殼結(jié)構(gòu)有利于鋰離子的脫嵌,而SnO2內(nèi)核則為電子的轉(zhuǎn)移提供了快速傳導(dǎo)路徑。
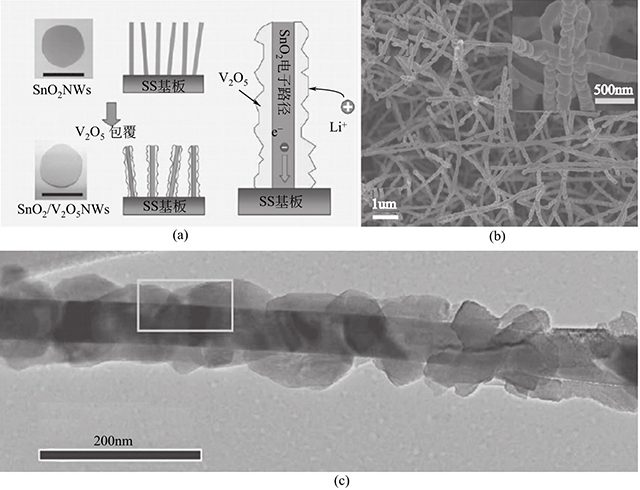
圖1-8 V2O5/SnO2核殼納米線(xiàn)的形成機(jī)理和形貌
綜上所述,構(gòu)筑特殊形貌的納米結(jié)構(gòu)、制備不同組分的異質(zhì)納米結(jié)構(gòu)對(duì)于提高鋰離子電池電極材料的性能具有重要的作用。因此,構(gòu)筑具有以上特點(diǎn)的納米材料對(duì)改善鋰離子電池性能具有重要的實(shí)際意義。
本文鏈接:http://m.qhgfjy.com.cn{dede:field.arcurl/}
諾信新聞,諾信公司新聞,鋰電池行業(yè)新聞,展會(huì)新聞