鋰離子電池在充放電時發生的反應
鋰離子電池在充電過程中,通過外加電壓,迫使電流以相反方向移動,導致鋰電池內的離子發生相反移動,發生電化學反應,從而將電能轉換為化學能。在放電過程中,正極、負極分別發生還原反應和氧化反應,此時相當于原電池。而在充電過程中則分別發生氧化反應和還原反應,這時相當于電解池。在電解池體系中,兩極一般分別稱為陰極和陽極(負極和正極),所發生的反應也分別稱為陰極反應和陽極反應。
鋰離子電池在長期的存儲過程中會出現自放電過大,由于自放電過大可能導致鋰離子電池的電壓過低,引起負極的銅箔溶解等風險,由于溶解的銅元素在充電的過程中會再次在負極表面析出,產生的金屬銅枝晶可能會刺穿隔膜,引起正負極短路,導致鋰離子電池徹底失效。
目前對于過放電過程中鋰離子電池內部發生的反應我們還不是特別清楚,為了了解這一反應過程,德國明斯特大學的JohannesKasnatscheew等人利用三電極體系對過放電過程中鋰離子電池正負極電壓的變化進行了詳細的研究。
實驗中JohannesKasnatscheew等采用的電池為NMC111/石墨體系,金屬鋰作為參比電極。從下圖a中可以看到,在充電的過程中隨著Li+從正極的脫出,正極的電勢緩慢升高,負極電勢在快速下降到1V以下,在放電的過程中正好相反,Li+從負極脫出回到正極,正極電勢逐下降,當負極完全脫鋰后,電勢迅速升高,并在3.56V左右出現了一個電壓平臺,下圖b為該區域的放大圖,從正負極電壓曲線上可以看到,正極電壓曲線的變化相對于負極有大約1h的延遲,隨后正極的電勢也開始快速下降,正極電勢低于負極石墨的電勢。該電壓曲線變化非常符合銅箔溶解的特點,銅箔中的銅元素首先被氧化為Cu1+,Cu1+遷移到正極表面并在正極表面還原,沉積為金屬銅。
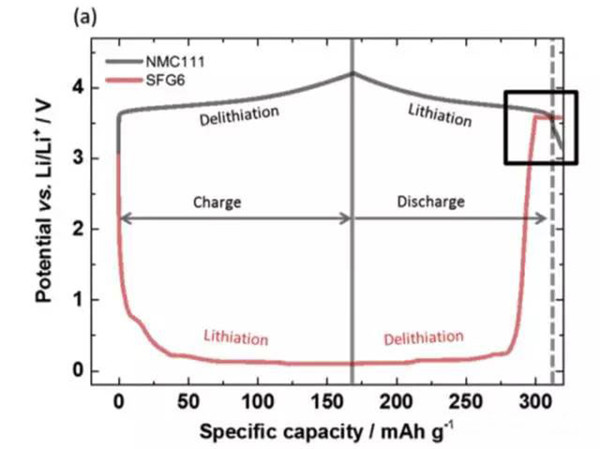
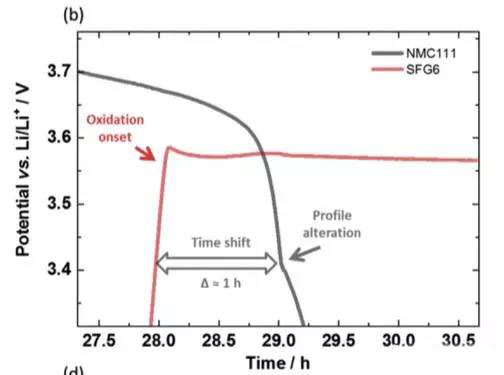
在整個過放電的過程中,正負極電勢變化如下圖所示,可以看到負極電勢維持在3.56V左右,對應的為銅箔的溶解。而正極電勢變化的趨勢則比較有特別,隨著銅箔的溶解,正極電勢達到了一個最低點,隨后有一些輕微的反彈,然后正極的電勢開始緩慢向著2.8V截止電壓下降,嵌鋰造成NMC電勢下降用綠色箭頭進行了標識,銅在NMC表面沉積造成的電壓下降用紅色箭頭進行了標識,Li+嵌入反應和銅的沉積同時在正極表面發生。
隨著放電狀態轉變為充電狀態,正負極的電勢發生了反轉,即正極電勢高于負極。但是我們看到充電時正極的電勢相當于充放電狀態反轉之前負極的電勢,這表明此時正極發生的反應為其表面沉積的銅再次溶解,這也驗證了負極銅箔在過放電過程中發生了溶解,并在正極表面發生了沉積。
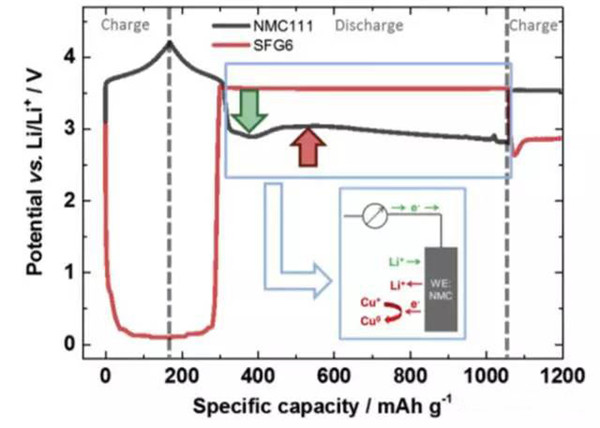
為了避免銅箔在放電的過程中發生氧化和溶解,就需要控制負極的電勢不高于3.56VvsLi+/Li。在實際的過程中,負極的電勢受到電池電壓的控制,下圖展示了當負極的首次效率高于正極,首次效率低于正極時,在充放電過程中的電勢的變化。當負極的首次效率高于正極時,由于正極損失的容量較多,因此在放電時雖然正極已經完全嵌鋰,但是負極仍然保有部分鋰,因此負極的電勢較低,也就不會發生銅箔溶解的問題。但是當負極的首次效率較低時,放電的過程中正極還沒有完全嵌鋰,此時負極的鋰已經消耗完畢,特別是放電截止電壓又比較低時,就有可能會導致負極的電勢過高,導致銅箔的溶解。因此為了避免銅箔的溶解就需要對鋰離子電池的放電截止電壓進行謹慎的選擇,避免負極的電勢過高。
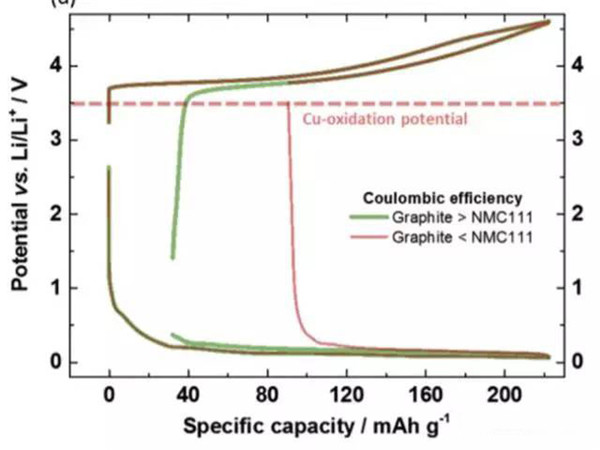
在電池的循環過程中,隨著負極SEI膜的不斷生長,消耗有限的Li+,可能會加劇負極Li+不足,導致其在放電的過程中電勢過高,引起銅的溶解,因此需要對壽命末期的鋰離子電池的截止電壓進行格外的關注,一般來說將放電截止電壓設的高一點有利于降低銅箔溶解的風險,因此JohannesKasnatscheew認為將截止電壓設為3V可以將銅箔溶解的風險降到最低,提高鋰離子電池的循環壽命。
本文鏈接:http://m.qhgfjy.com.cn{dede:field.arcurl/}
諾信新聞,諾信公司新聞,鋰電池行業新聞,展會新聞